Navigazione di servizio
Ricerca
Una premessa è doverosa, questo blog non vuole essere un'ode all'alcol, meglio consumare acqua.

Se al posto dell'acqua ci fosse alcol il nostro pianeta sarebbe decisamente inospitale. Basterebbe una scintilla, un fulmine, per generare un immenso barbecue, e non in senso figurato. Le piogge incendiarie cadrebbero su mari e laghi in fiamme, una visione dantesca dell'apocalisse. Se solo riuscissimo a sfuggire a questo inferno di fiamme e fuoco sarebbe una salvezza di breve durata, la combustione dell'alcol consumerebbe tutto l'ossigeno presente, lasciandoci senza fiato. Ma tutto questo è uno scenario puramente ipotetico, infatti in un mondo di oceani alcolici non avremmo mai ossigeno a sufficienza per la vita, essendo l'alcol infiammabile. Semplicemente non ci sarebbe posto per gli esseri umani.
In effetti non ci sembra di essere scientificamente sobri, ma lasciamo libertà all'immaginazione, ipotizzando alcune situazioni, alquanto alterate, nella stesura di questo blog. La prima alterata verità è che l'essere umano possa vivere su di un pianeta senza acqua, sostituita da alcol.
La piccola molecola d'acqua ha alcune caratteristiche tipiche delle molecole più grandi.
Il motivo per cui l'alcol (etanolo) è stato scelto come sostituto dell'acqua in questo blog è che in presenza dei tipici valori di pressione atmosferica sulla superficie terrestre, il suo punto di ebollizione (circa 79 °C) è relativamente simile a quello dell'acqua. In un mondo con le temperature e pressioni alle quali siamo abituati, potrebbero quindi esserci anche piogge e mari alcolici. Molto più realistiche, invece, sarebbero altre sostanze come il metano (presente ad esempio su una luna di Saturno, Titano) o l'anidride solforosa (come ad esempio su Venere). Tuttavia, queste sostanze bollono a temperature molto più basse. Un mondo in cui queste sostanze si trovano allo stato liquido sarebbe davvero gelido per noi.
Il punto di ebollizione dell'acqua è sorprendentemente alto. Come regola generale, più una molecola è piccola e leggera, più basso è il suo punto di ebollizione. L'acqua (H2O) è una molecola piccola e leggera. Una molecola d'acqua è persino meno pesante delle più comuni molecole che compongono l'aria, vale a dire ossigeno e azoto. Ci si aspetterebbe quindi che l'acqua abbia un punto di ebollizione basso. Invece, il punto di ebollizione è molto alto, pari a 100 °C. Questo si può notare anche dal confronto con il fratello maggiore dell'acqua, l'idrogeno solforato, dal punto di vista chimico. Questa molecola contiene un atomo di zolfo (H2S) invece di un atomo di ossigeno. Questa molecola è quasi due volte più pesante di una molecola d'acqua e tuttavia bolle a -61 °C.
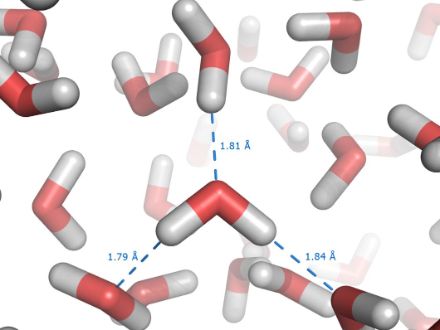
Le molecole d'acqua si legano tra loro
Il motivo dell'elevato punto di ebollizione dell'acqua risiede nel fatto che le singole molecole d'acqua si attraggono fortemente l'una con l'altra. Di conseguenza, diverse molecole d'acqua formano una sorta di "pseudo-molecola" più grande e sciolta. Si parla di legame a idrogeno.
L'alcol non è un buon equilibratore
L'acqua è un vero e proprio accumulatore di energia termica. Non esiste un'altra sostanza comune in grado di immagazzinare tanta energia termica per chilogrammo quanto l'acqua. Se si raffredda di un grado un chilo di acqua e un chilo di alcol, l'acqua cede quasi il doppio di energia termica rispetto all'alcol.
Sulla nostra ipotetica Terra a base alcolica questa è una pessima notizia per l'Europa. La corrente del Golfo in un oceano di alcol riscalderebbe molto meno l'Europa che non con oceani di acqua.
Un'Europa gelida

Un'altra proprietà particolare dell'acqua è che al suo stato solido (il ghiaccio) è meno densa rispetto allo stato liquido. Ciò non avviene per la maggior parte delle altre sostanze, compreso l'alcol. Sulla Terra dell'alcol, questo fatto sarebbe inizialmente un vantaggio per la navigazione, poiché i mari polari non si ghiaccerebbero. Quando farà veramente freddo e appena si forma il ghiaccio sul mare di alcol, questo scenderà verso il fondo marino, l'oceano rimarrà così navigabile. Tuttavia, uno strato di ghiaccio si accumulerà sul fondo marino inverno dopo inverno. Dopo alcuni anni (millenni?), lo strato di ghiaccio sottomarino diventerebbe così spesso da raggiungere la superficie dell'oceano. A questo punto, non sarà solo il trasporto marittimo a essere in difficoltà. I ghiacciai sottomarini bloccheranno le correnti oceaniche e quindi anche la corrente del Golfo. L'Europa subirà una vera e propria glaciazione.
Tempestoso, ma con temporali annebbiati dall'alcol
Con il blocco delle correnti oceaniche, la differenza di temperatura tra i poli e le regioni tropicali sarà ancora maggiore. Questo porterà a sua volta a tempeste più violente alle latitudini temperate. Sulla Terra alcolica, l'Europa sarebbe quindi un continente ostile, freddo e tempestoso. Perlomeno i temporali sarebbero un po’ meno intensi.

I temporali traggono la loro energia dall’energia rilasciato durante la condensazione del vapore acqueo. Quando un chilo di alcol si condensa, viene rilasciato solo un terzo dell'energia rispetto all'acqua. Supponendo di aver sostituito tutta l'acqua con l'alcol i temporali avrebbero dunque a disposizione solo un terzo dell'energia. Sarebbero quindi più innocui, come anche i cicloni tropicali che si alimentano in modo simile. Rispetto ad essi però la mancanza dell'effetto equilibratore, specifico all'acqua, porterebbe ad oceani più caldi ai tropici, generando una maggiore evaporazione, e di conseguenza favorendo lo sviluppo di cicloni di rara violenza.
In tutte queste considerazioni, abbiamo ignorato l'effetto serra provocato dall'alcol. Questo avrebbe un impatto molto forte sul clima. Ma avremmo problemi ancora più gravi da risolvere.
Una cosa è però chiara: con le altre sostanze che si trovano comunemente nell'universo, come sostituto dell'acqua, un clima come quello terrestre attuale non è possibile.
Onore a chi lo merita, l'acqua

Sono molteplici le qualità che rendono l'acqua una sostanza unica e essenziale per la nostra vita. Provate anche voi a approfondire il tema, magari giocando come noi in questo blog.
Certo è che l'alcol presente in una bevanda non reggerà mai il confronto rispetto al suo contenuto in acqua.