Navigazione di servizio
Ricerca
"Sono felice che tu sia qui, ma per favore stai lontano da me". Questa curiosa affermazione si applica perfettamente all'ozono. Esso ci protegge dalle pericolose radiazioni UV, ma risulta tossico per la salute umana (è irritante per le mucose).
Negli ultimi decenni, l'uomo ha involontariamente causato la diminuzione dell'ozono protettivo nella stratosfera, mentre è aumentato nell'aria che respiriamo, ovvero a livello della troposfera. Un motivo in più per dedicare un blog a questo gas, alla sua storia, alla suo ciclo di vita e altre curiosità.
Condizioni proibitive
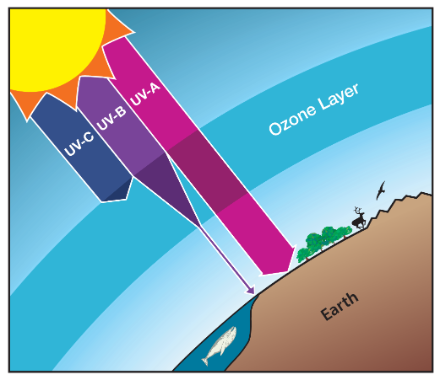
Nell'atmosfera c'è uno strato tra i 15 e i 50 km di altezza chiamato stratosfera, dove si trova lo strato di ozono che ci protegge. Qui non ci sono condizioni ideali per la vita terrestre. Non solo l'aria è troppo rarefatta e l'ossigeno motlo scarso, ma le radiazioni solari sono così aggressive che non riusciremmo a sopravvivere a lungo. Per l'ozono, invece, è la zona perfetta: le radiazioni ad alta energia dividono le molecole di ossigeno in due singoli atomi.
Ricerca ossessiva del partner
In chimica vige una regola: gli atomi - con poche eccezioni - sono molto restii a rimanere da soli. Se un atomo è solo, cerca immediatamente di unirsi a un altro atomo. Nel farlo, spesso è piuttosto pretenzioso. Non esita a modificare o addirittura a rompere i legami esistenti tra altri atomi solo per poter formare un nuovo legame con lui stesso. Non c'è da stupirsi che in chimica questi singoli atomi siano chiamati "radicali liberi".
Nel caso dell'ozono, stiamo parlando dell'ossigeno. Gli atomi di ossigeno cercano due legami. L'ossigeno che respiriamo non è quindi composto da singoli atomi, ma da una molecola con due atomi di ossigeno (le molecole sono due o più atomi legati tra loro). Nella molecola di ossigeno, i due atomi sono collegati da un doppio legame. La molecola risulta quindi stabile, in quanto "soddisfatta" perché ha ottenuto i suoi due legami come fortemente desiderato.
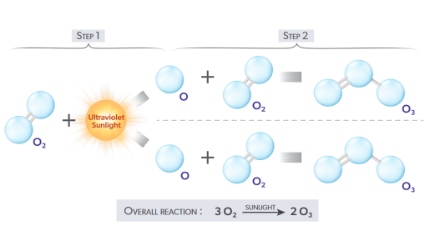
Nella stratosfera, tuttavia, la relazione pacifica tra i due elementi viene distrutta: le radiazioni UVC rompono il doppio legame e si formano due radicali dell'ossigeno. Questi cercano subito di formare nuovamente composti con altri atomi. I radicali possono farlo in due modi: i due radicali si ricollegano all'atomo di ossigeno o un radicale cerca forzatamente di attaccarsi a una molecola di ossigeno (vedi figura). Così facendo, rompono il doppio legame esistente e si forma l'ozono, una molecola composta da tre atomi di ossigeno.
I raggi UV si scavano la fossa da soli
La radiazione UVC, che separa la molecola di ossigeno, viene "consumata" durante questo processo, cioè assorbita. L'ossigeno ci protegge quindi da queste radiazioni. Tuttavia, l'ozono che si è creato assorbe anche le radiazioni UVB, che altrimenti attraverserebbero l'atmosfera senza problemi. In questo senso, la radiazione UVC, con la scissione dell'ossigeno e la formazione dell'ozono, conduce all'assorbimento della maggior parte dei raggi UVB. La radiazione UV assorbita viene quindi convertita in calore. Questo è anche uno dei motivi per cui la stratosfera è relativamente calda e rappresenta uno strato barriera per i fenomeni meteorologici, come descritto nell'ultimo blog.
Tuttavia, nell'ultimo secolo noi esseri umani abbiamo danneggiato notevolmente lo strato di ozono con il rilascio dei clorofluorocarburi (CFC). I CFC sono sostanze chimiche non tossiche e non infiammabili, per questo inizialmente erano considerati prodotti ideali e innocui. Purtroppo, si è scoperto che quando queste sostanze raggiungono la stratosfera, hanno una proprietà piuttosto sgradevole: I raggi UV nella stratosfera scindono i CFC in radicali che a loro volta distruggono l'ozono. Inoltre questi radicali sopravvivono indenni a questo processo: ogni singolo radicale può "distruggere" quindi molte molecole di ozono indisturbato.
Fortunatamente, però, il divieto mondiale di vasta portata sui CFC sta dando i primi risultati e lo strato di ozono sembra lentamente riprendersi.
Il lato tossico dell'ozono
A contatto diretto l'ozono risulta tossico per le sue proprietà irritanti. Il motivo è da ricercare nella struttura dell'ozono. I tre atomi sono collegati con una sorta di "un legame e mezzo". Gli atomi di ossigeno, invece, preferirebbero avere due legami veri e propri. Se l'ozono si avvicina a un'altra molecola (ad esempio nei nostri polmoni), gli atomi di ossigeno cercano di soddisfare la loro ossessiva necessità di legami. Così facendo, rompono i legami esistenti nelle molecole delle nostre cellule, il che ovviamente non giova alla salute. Questo effetto dannoso sulle cellule (effetto irritante) è così forte in concentrazioni elevate che l'ozono nell'acqua (acqua ossigenata) viene utilizzato anche per la disinfezione.

Ozono indesiderato
Senza le attività umane, a livello del suolo si formerebbe poco ozono, in quanto mancherebbero le radiazioni UVC necessarie. I gas di scarico, tuttavia, favoriscono la sua formazione. In particolare, il biossido di azoto si decompone già sotto l'influenza dei raggi UVA. Questo produce radicali di ossigeno che, come nella stratosfera, formano successivamente l'ozono. Questo processo avviene in modo particolare alle alte temperature e in presenza di un forte irraggiamento solare, motivo per cui i livelli di ozono al suolo sono più elevati nei giorni estivi. Chi ama praticare sport dovrebbe quindi farlo preferibilmente al mattino e poi di nuovo in tarda serata in estate. In fondo, non abbiamo bisogno una dose supplementare di radicali osessionati di legami nei nostri polmoni!.