Navigazione di servizio
Ricerca
Concetti di base
Qualsiasi gas esercita una certa pressione sull'ambiente in cui si trova, e questa pressione dipende essenzialmente dalla temperatura del gas (per un dato volume, che non cambia); ad esempio in estate, quando fa molto caldo, la pressione negli pneumatici di un'automobile aumenta. Il vapore acqueo, essendo un gas, non fa eccezione a questa regola: più è caldo, maggiore è la pressione che esercita. Il vapore acqueo rappresenta una parte molto piccola della massa gassosa dell'atmosfera (dallo 0,1 al 5%, a seconda della regione), motivo per cui il suo contributo alla pressione totale in un determinato luogo viene definita come "pressione parziale di vapore acqueo". Questa pressione parziale varia quindi notevolmente da un luogo all'altro.
A una data temperatura, la quantità massima di vapore che può contenere un pacchetto d'aria è fissa. La pressione di vapore corrispondente a questo massimo è chiamata "pressione di vapore saturo". Si tratta di un punto di equilibrio dinamico, in cui il numero di molecole d'acqua che fuoriescono dalla superficie sotto forma di gas è uguale al numero di molecole d'acqua che dall'atmosfera entrano nel liquido; la tensione di vapore saturo è quindi strettamente legata alla temperatura del liquido. Quando la pressione parziale di vapore acqueo è uguale alla pressione di vapore saturo, la massa d'aria raggiunge il 100% di umidità.
Un liquido bolle quando la sua pressione di vapore saturo è uguale alla pressione totale all'esterno del liquido. Per far bollire l'acqua ci sono quindi due possibilità: aumentare la sua temperatura o ridurre la pressione del recipiente in cui è contenuta. All'aria aperta, l'acqua bolle quando la pressione di vapore saturo è uguale alla pressione atmosferica. Il punto alla pressione atmosferica standard al livello del mare (1013 hPa) fu scelto da Anders Celsius nel 1742 per stabilire il grado 100 della sua scala di temperatura centigrada.
Più concretamente
Poiché la tensione di vapore saturo è direttamente correlata alla temperatura del liquido, più alta è la temperatura, più alta è la tensione di vapore. Di conseguenza, qualsiasi variazione della pressione atmosferica modifica la temperatura di ebollizione dell'acqua: un aumento della pressione atmosferica aumenta questa temperatura, mentre una diminuzione della pressione atmosferica la abbassa.
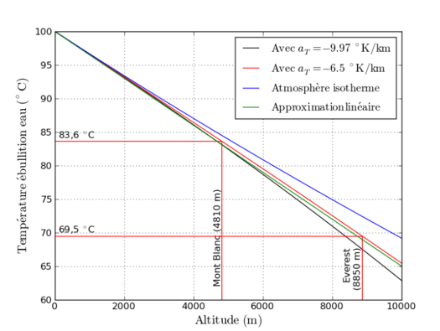
La figura 1 mostra che per far bollire l'acqua a livello del mare è necessario riscaldarla a 100°C; a circa 1500 m sulle creste delle montagne del Giura, dove la pressione atmosferica è di circa 850 hPa, l'acqua bolle a circa 95°C. Sulla vetta del Monte Bianco (a circa 500 hPa), l'acqua bolle a circa 84°C, e sulla vetta dell'Everest a soli 70°C.
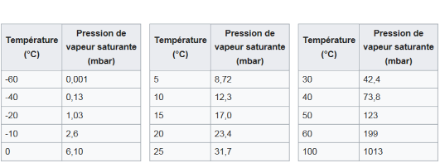
La figura 2 mostra che a 100°C la pressione di vapore saturo è pari alla pressione atmosferica standard al livello del mare (1013 hPa). Questa tabella mostra anche che è possibile far bollire l'acqua a temperatura ambiente (circa 15°C) se si abbassa la pressione atmosferica a circa 17 hPa, che in atmosfera libera rappresenta un'altitudine di oltre 20'000 m! Questo esperimento viene spesso eseguito nei laboratori di fisica dei licei e delle scuole superiori facendo bollire l'acqua sotto una campana di vetro e riducendo la pressione.
Una volta che l'acqua bolle, la sua temperatura rimane costante, anche se l'acqua viene tenuta sopra una fonte di energia. L'energia aggiuntiva non viene utilizzata per riscaldare l'acqua, ma per farla passare dalla fase liquida a quella gassosa.
Ad esempio, la cottura dei cibi in alta montagna richiederà molto più tempo rispetto alle zone di pianura, poiché non è possibile riscaldare l'acqua oltre il suo punto di ebollizione, che può essere molto più basso rispetto al livello del mare. Come abbiamo visto nella Figura 1, non è possibile riscaldare l'acqua oltre i 70°C sulla cima del Monte Everest. L'altra soluzione sarebbe quella di portare con sé una pentola a pressione, che permetterà di aumentare la pressione interna.
A 20'000 m, in atmosfera libera, non sarebbe possibile cuocere i cibi perché la temperatura dell'acqua non potrebbe salire oltre i 15°C... ma sarebbe comunque "bollente"!